线粒体与皮肤健康、衰老和疾病(上篇)
编者荐语:
转载彗搏调研团队发表于“弗图医学”公众号的线粒体系列编译文章第三篇(上篇)
以下文章来源于弗图医学,作者卢云宇 李洋 译
摘要:
皮肤是一个高周转器官,其不断更新依赖于其祖细胞的快速增殖。这些代谢层面上的活性细胞的能量需求通过线粒体呼吸来满足,这是一个由一系列蛋白质复合体驱动的ATP生成过程,这些位于线粒体内膜上的复合体统称为电子传递链(ETC)。
然而,呼吸过程中不可避免地会产生活性氧(ROS),如超氧化物、单线态氧、过氧化物,并且如果不通过抗氧化剂系统猝灭,则会破坏大分子和细胞结构。由线粒体ROS产生所引起的氧化损伤已被确定为多种病理生理状况(包括衰老和癌症)的分子基础。
不足为奇的是,线粒体是在随时间推移和紫外线诱导所致皮肤衰老的过程中受影响的主要细胞器,而皮肤衰老的表型表现是线粒体功能障碍的直接后果。此外,在光老化的皮肤和皮肤癌病灶中,线粒体DNA(mtDNA)的缺失和其他异常也很常见。
最近的研究表明,线粒体在维持皮肤稳态和色素沉着方面具有更为先天的作用,且当线粒体的基本功能受损时,皮肤稳态和色素沉着就会受到影响。一些常见和罕见的皮肤病均与线粒体有关,包括原发性线粒体疾病的皮肤表现以及由线粒体受损引起的先天性皮肤病。
随着越来越多的研究支持线粒体与皮肤健康之间的密切联系,其在皮肤中的治疗靶向性(无论是通过促进ATP的生成还是自由基的清除)已经引起了临床医生甚至是美容师的关注。不少生物活性化合物已经被鉴定为可以改善线粒体功能,并且已经证明其对衰老和患病的皮肤有效。这篇综述讨论了线粒体在调节正常和异常皮肤生理中的重要作用,以及在各种皮肤病中靶向该细胞器的可能性。
事实
SPRING
皮肤是人体内最大的器官,具有高周转率。
线粒体在皮肤中起着至关重要的作用。
线粒体功能障碍导致皮肤老化。
皮肤病表现出线粒体功能障碍。
靶向线粒体可能有助于恢复皮肤活力。
开放式问题
线粒体如何调节皮肤衰老?
线粒体功能障碍是皮肤衰老的主要原因还是次要原因?
靶向线粒体能预防或减缓皮肤衰老吗?
引言
皮肤是人体的外部护套,与外部环境相接触。它是由几个组织层组成的复杂结构,每个组织层都由不同的细胞组成。皮肤具有至关重要的功能,如感觉、隔热和防止水分流失,并且作为物理屏障阻挡病原体。皮肤的上层是表皮,一种散布着毛囊的层状结构。
表皮外表面由角质细胞或角质细胞组成,形成一个角蛋白细丝构成的致密细胞骨架网络。同时,基底层含有表皮干细胞和祖细胞,它们不断再生成表皮。真皮位于表皮之下,含有能产生胶原蛋白和弹性蛋白进而形成细胞外基质(ECM)的真皮成纤维细胞,以及能产生光保护性色素——黑色素的黑素细胞。
随着年龄的增长,表皮和真皮均会变薄并失去其再生能力,表现为皱纹、干燥和色斑。此外,长期暴露于诸如紫外线(UV)辐射等环境元素中也会对皮肤细胞产生有害影响。UVA和UVB辐射不仅与皮肤过早光老化有关,还与各种炎症反应和皮肤癌有关。
皮肤是高周转器官,具有不断再生的表皮。表皮祖细胞因此具有很高的增殖和代谢活性,并依赖三磷酸腺苷(ATP)满足其能量需求。ATP主要通过线粒体中的氧化磷酸化(OXPHOS)产生,而线粒体是真核细胞的生物能量学中心。
这种双重膜结构的细胞器参与诸多基本功能,如能量产生、脂肪酸氧化(FAO)、血红素和类固醇生物合成、细胞凋亡和钙信号传导。线粒体呼吸利用位于内膜的一系列蛋白质复合体,统称为电子传输链(ETC)。这些复合体循序进行电子传输并将质子转移到膜间隙,形成质子梯度,将其用于生成ATP(图1)。
氧化磷酸化的天然副产物包括活性氧(ROS),如超氧阴离子、单线态氧和过氧化物,它们会破坏大分子和细胞结构。尽管ROS的产生可以通过电离辐射和致癌物等外部刺激来触发,但内源性ROS的生成在线粒体中是最高的。线粒体ROS产生引起的氧化损伤是包括衰老和癌症在内的各种病理生理状况的重要分子基础。
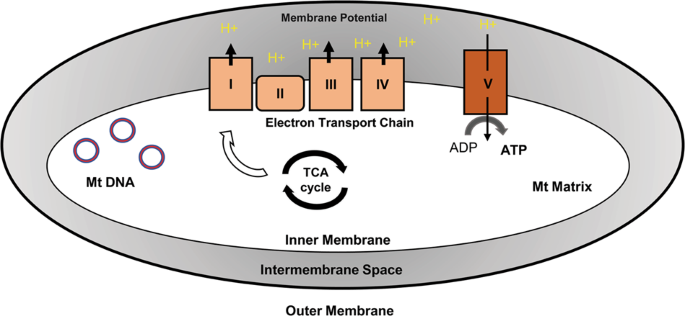
图1-线粒体是一种双膜细胞器,存在于几乎所有真核细胞的细胞质中。它是细胞呼吸和大多数ATP产生的场所。线粒体呼吸利用一系列蛋白质复合体:位于线粒体内膜的复合体I (NADH脱氢酶)、复合体II(琥珀酸脱氢酶)、复合体III(细胞色素c还原酶)和复合体IV(细胞色素c氧化酶)。这些复合体循序转移电子(e-),形成质子梯度(H+)。然后,复合体V (ATP合酶)利用该梯度将ADP磷酸化为ATP。
线粒体是一个具有母系遗传自主基因组的独特细胞器。线粒体DNA(mtDNA)编码13种氧化磷酸化蛋白,此外还有22种tRNA和2种rRNA(图2)。mtDNA由于物理上接近ETC以及ROS,因此极易突变,进而总是破坏氧化磷酸化,从而引发一个ROS产生持续增加和mtDNA持续损伤的恶性循环。
mtDNA的体细胞突变经常出现在包括癌症在内的各种疾病中。此外,mtDNA以多拷贝形式存在,且研究表明异常拷贝数量与不同的病理生理状态相关联。某些mtDNA突变或单核苷酸多态性(SNPs)可以在种群中持续存在,从而产生具有不同地理分布的单倍群;目前,已知大约有27个主要的线粒体单倍群,其中许多与癌症和包括皮肤癌的其他疾病的高风险相关。
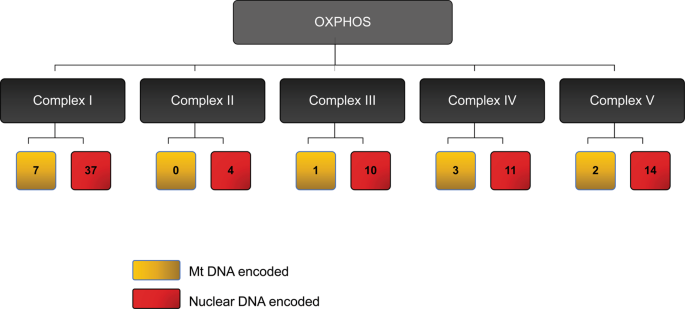
哺乳动物呼吸链复合体的示意图。ETC由五个复合物组成,其亚基由mtDNA(黄色)和核DNA(红色)编码。人类的mtDNA基因组仅编码13种氧化磷酸化蛋白,而核DNA则编码其余80%的氧化磷酸化蛋白。
本文已经讨论了线粒体在调节正常皮肤生理以及健康/过早皮肤衰老和皮肤癌中的重要作用。此外,线粒体在各种皮肤病中的治疗靶向性也已经考虑在内。
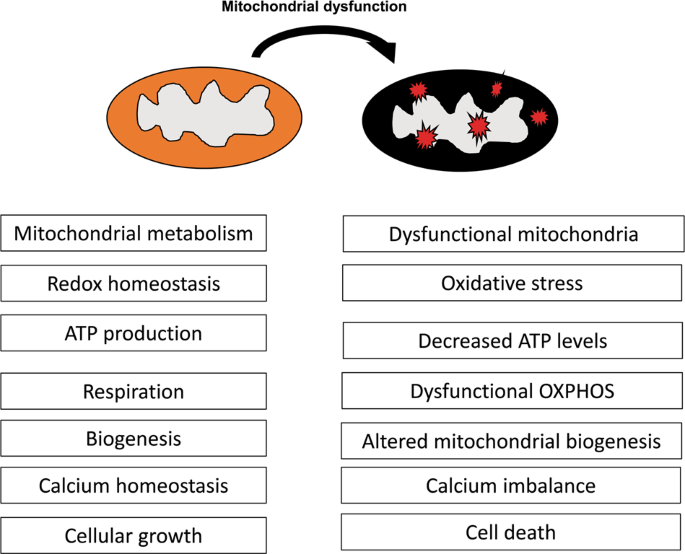
线粒体功能障碍伴随着ROS产生的增加、抗氧化防御机制的减少、细胞呼吸的改变、代谢的改变和细胞死亡的增加。
线粒体在皮肤稳态中的作用
线粒体依赖性表皮分化
SPRING
表皮是一个自我更新层,这依赖于增殖的基底角质形成细胞随后向最外表皮层的角质化角质形成细胞分化和迁移的过程。越来越多的研究表明,线粒体ROS的产生通过多种下游转录因子如C/EBP,Notch和β-连环蛋白(β-catenin)在各种细胞系的分化中起调节作用,并且ROS水平的增加促进鼠胚胎干细胞(ESCs)、诱导多能干细胞(iPSC)以及组织特异性多能上皮干细胞的分化。
Hamanaka等发现,条件性线粒体转录因子A(TFAM)敲除的小鼠,由于表皮屏障功能受损和缺乏正常毛皮,而具有较高的新生儿死亡率。此外,从这些小鼠分离的原代角质形成细胞未能在体外分化。由于TFAM驱动mtDNA复制,而缺乏TFAM的细胞具有氧化磷酸化缺陷和较低水平ROS,因此有理由推测线粒体呼吸作用和ROS产生对于角质形成细胞的分化至关重要。
事实上,对野生型角质形成细胞的抗氧化剂处理阻断了其分化,而外源性给予H2O2在TFAM-/-角质形成细胞中恢复了同样的作用。进一步的机理分析表明,线粒体ROS(mROS)通过激活Notch和β-连环蛋白信号级联反应来促进表皮分化。此外,暴露于生理剂量UVB射线的皮肤成纤维细胞产生的低水平H2O2激活了角质形成细胞生长因子受体(KGFR)并促进其角质化。
线粒体呼吸也需要摄取Ca2+,并且在体内表皮中已观察到Ca2+梯度。通过增加Ca2+水平可增强体外角质形成细胞的分化,而抑制线粒体钙摄取则可看到相反的效果。在最近的研究中,Bhadhuri等人使用基于基因网络的生物信息学方法来筛选参与表皮分化的中枢蛋白,并鉴定出线粒体蛋白MPZL3和FDXR。
功能分析进一步表明,这些蛋白质在角质形成细胞线粒体中共定位于相近的位置,并通过诱导ROS的产生促进其分化。有趣的是,髓磷脂蛋白零样3(MPZL3)的缺失与小鼠皮炎和脱发有关,并且ETC酶铁氧还蛋白还原酶(FDXR)使各种人上皮细胞系对ROS诱导的细胞凋亡敏感。Allombert-Blasie等人证实,角质形成细胞的终末分化伴随着线粒体半胱天冬酶(caspase)依赖性凋亡途径的激活。
皮肤中的褪黑素-线粒体轴
褪黑素(melatonin ,N1-乙酰基-5-甲氧基色胺)是一种由松果体分泌的神经激素,调节哺乳动物的昼夜节律。它也可以在其他器官中合成,如视网膜、耳蜗、肺、肝、肾、免疫系统和皮肤,其水平受肝脏和表皮代谢的严格调节。
除了调节伤口愈合、色素沉着、炎症和免疫反应外,它在皮肤组织中还具有关键的光保护作用。褪黑素及其代谢产物在紫外线或X射线照射后直接作用于表达G蛋白偶联褪黑素类型(MT)1和2受体的皮肤细胞,并通过清除辐射诱导的自由基来减轻大分子损伤。
体外实验显示药理剂量的褪黑素可保护角质形成细胞和黑素细胞免受UVB诱导的损伤。经褪黑素预处理后,暴露于紫外线的离体培养全层人体皮肤的DNA损伤标记物8-羟基-2'-脱氧鸟苷(8-OHdG)的水平明显降低。除了直接清除诸如H2O2、单线态氧和NO-之类的ROS外,褪黑素及其衍生物还可以通过增加抗氧化酶的活性来保护皮肤细胞免受辐射损伤。
有趣的是,除了涉及褪黑素合成和代谢的酶之外,在人和啮齿动物的皮肤细胞(包括黑素细胞、角质形成细胞和上皮细胞)中还检测到了高水平的内源性褪黑素。
褪黑素在皮肤中强大的辐射防护和抗氧化作用增加了线粒体参与的可能性。确实,越来越多的研究指出褪黑素与表皮线粒体之间存在“共生”关系,后者是皮肤褪黑素生物合成和代谢的场所。
相比之下,褪黑素对线粒体ETC和抗氧化机制具有调节作用。褪黑素在线粒体内通过细胞色素c和H2O2依赖的犬尿酸途径和细胞色素P450依赖性吲哚途径进行代谢。褪黑素的主要代谢产物包括N1-乙酰基-N2-甲酰基-5-甲氧基犬尿胺(AFMK)、6-羟基褪黑素和N-乙酰血清素,它们在暴露于UVB后以剂量依赖性方式在表皮中积累。
线粒体中也可能存在褪黑素生物合成机制,因为卵母细胞线粒体可以在无细胞系统中从血清素(5-羟色胺)合成褪黑素。不过皮肤线粒体是否也具有类似功能仍有待阐明。褪黑素可以直接增加通过呼吸链的电子流量,并通过提供电子来增强ATP的产生。
一项研究表明,6-羟基褪黑素促进了从复合体III到复合体IV(细胞色素c氧化酶)的电子转移,这可能有助于改善线粒体生物能量学的年龄依赖性下降的趋势。此外,褪黑素介导细胞色素c的还原和H2O2清除率的增加。
线粒体在皮肤衰老中的作用
除了时间诱发的必然变化之外,由于长期暴露于太阳UVA和UVB辐射下,皮肤也极易受到光老化的影响。衰老影响皮肤对抗物理化学和生物学攻击以及其温度调节、感觉、免疫和激素功能的保护作用。与随年龄老化的皮肤相比,光老化皮肤在其老化的结构和功能表现层面为时更早,并且更为严重。
此外,由于光老化是一个累积过程,因此其在长期规律性暴露于阳光下的老年人群中更为明显。内在因素和环境因素都会影响皮肤的表皮和真皮层。从组织学上看,随年龄老化的特征是表皮明显变薄,表现为干燥和皱纹。
与之相反,光老化的皮肤具有厚实的皮质外观,皱纹更深,色素沉着不均匀。多项研究直接或间接地将线粒体功能障碍与皮肤随年龄老化以及光老化联系在一起。在分子水平上,衰老皮肤的特征在于同时在真皮层和表皮层中的线粒体受损、mtDNA缺失、高水平ROS以及氧化应激(图4)。
图4:皮肤老化中的线
皮肤随年龄老化
众所周知,随着年龄的增长,mtDNA的突变和缺失会在复制后的组织中积累,伴随着线粒体功能的稳定下降、ROS产生的增加以及线粒体膜电位(MMP)的丧失,继而导致线粒体自噬和细胞凋亡的增强。
mtDNA中一个含有编码呼吸链复合体I、IV和V基因的4977个碱基对的扩展区在老年人皮肤中经常缺失。这种“常见的缺失”在70岁以上人群皮肤中更为明显,并随着日晒而增加。Kaneko等人比较德国和日本女性的颈部皮肤样本后发现,与光保护皮肤相比,常见缺失的频率随年龄以及日晒均普遍增加。
此外,在日本女性中,常见缺失的密度与皮肤皱纹之间存在很强的正相关性;而在德国女性中,常见缺失的较高频率与较少的色素沉着相关。德国女性较日本女性的常见缺失量略高,这可能是由于内源性遗传变异或对日晒的不同文化态度所致。
在最近的研究中,Singh等人在mtDNA聚合酶POLG1中建立了具有显性负突变的诱导型mtDNA耗竭小鼠模型,小鼠表现出mtDNA的普遍缺失以及氧化磷酸化的相应减少,表型表现包括广泛的皮肤皱纹和皮毛脱落,这反过来又与表皮增生和角化过度有关。转基因小鼠也表现出在皮肤老化过程中经常出现的基质金属蛋白酶水平的升高。
有趣的是,关闭突变体POLG1的表达可使皮肤病理恢复到野生型水平。这项研究首次证明了mtDNA缺失是皮肤衰老的潜在根本原因,并且证明了恢复线粒体功能可以使皮肤恢复年轻。
角质形成细胞中ROS的年龄依赖性积累,以及随之而来的MMP丢失,导致代谢方式从氧化磷酸化到厌氧糖酵解的转变。Prahl等人从老年和年轻捐献者的皮肤活检物中分离出角质形成细胞,在老年角质形成细胞中发现了明显的糖酵解表型,并且发现添加ETC组分辅酶(Co)Q10恢复了衰老细胞中的线粒体代谢。
与此相一致,在老年人皮肤成纤维细胞中也观察到了复合体II(琥珀酸氧化还原酶)的活性与年龄有关的下降。受损的线粒体通过一种高度保守的途径被清除,这种途径被称为线粒体自噬(mitophagy)或线粒体的选择性自噬(selective autophagy of mitochondria)。
细胞应激或损伤后,自噬水平显著增加,线粒体生物合成与线粒体自噬之间的稳态对于健康的线粒体池至关重要。Aymard等人证明了自噬(autophagy)和线粒体自噬(mitophagy)在角质形成细胞分化中的关键作用,这也增加了由ROS水平随年龄升高以及氧化应激导致的线粒体分裂的增加所引起的老化角质形成细胞中线粒体片段化的可能性。
最近Mellem等人首次在体内研究了年轻和老年皮肤中的线粒体网络,发现角质形成细胞中的线粒体簇明显减少。与老年皮肤相比,年轻表皮细胞的线粒体具有高度连接的物理网络。而年老皮肤线粒体网络非常分散,表明其循环不良和过度自噬。这种线粒体动力学在正常分化和衰老中的相似性,可能归因于衰老过程中失调的常见途径,或是由于衰老相关的表皮周转率的减少。
辅酶Q(CoQ10)是一种亲脂性异戊二烯基化的醌类化合物,在ETC复合体I/II和III之间起电子穿梭作用,并作为防止膜脂氧化的ROS清除剂。CoQ10的抗氧化和生物能功能均与皮肤衰老和其他疾病密切相关。
CoQ10在表皮中的水平比真皮高10倍,且随年龄而显著降低。老化皮肤的成纤维细胞中CoQ10含量的降低与复合体I/III和II/III的活性降低、膜去极化以及超氧阴离子的产生有关。
此外,一些研究表明,在光老化皮肤上局部应用CoQ10可以改善衰老的表现型,并恢复线粒体功能。Prahl等人报道的人角质形成细胞中与年龄有关的糖酵解转变也与CoQ10功能受损有关,并可被其外源性应用所逆转。
CoQ10是通过甲羟戊酸途径从头合成的,可以被3-羟基-3-甲基-戊二酰辅酶A(HMG-CoA)还原酶抑制剂(如他汀类)抑制。Marcheggiani等人最近的研究表明,人皮肤成纤维细胞中他汀类药物介导的CoQ10抑制作用会触发氧化应激和线粒体功能障碍,并在体外导致细胞过早“衰老”。

